Exacte vakken
Hulp bij leren
Bekijk onze uitlegfilmpjes, stel een vraag in de vraagbaak, doe een oefentoets of bekijk profielwerkstukken voor scheikunde.

Uitlegfilmpje
Hoe herken je redoxreacties?

Uitlegfilmpje
Molmassa berekenen

Leertip
Hulp nodig bij je bèta profielwerkstuk?

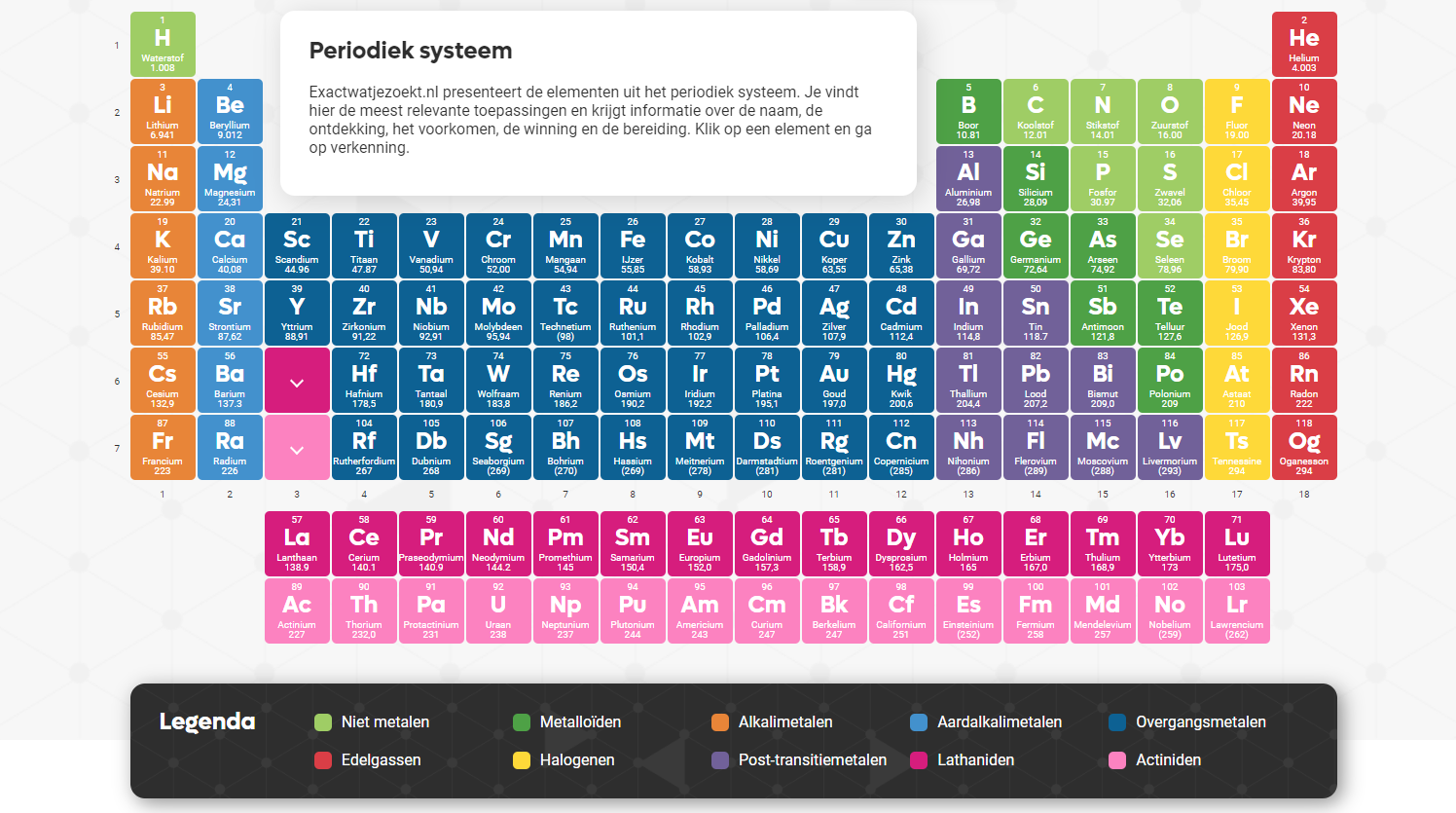
Het online periodiek systeem van exactwatjezoekt.nl

Eerste hulp bij profielkeuze
Hulp bij kiezen
Studiekeuze
Test jezelf en ontdek alles over opleidingen en beroepen in bèta en techniek.

Beroep
Vliegtuigen repareren doe je zo

Beroep
Met het profiel techniek kon ik alle kanten op

Studie
Zet je in voor een schoner milieu



Studiekeuzetest




















